- HISTORIA DE LA QUIMICA
La historia de la química abarca un periodo de tiempo muy amplio, que va desde la prehistoria
hasta el presente, y está ligada al desarrollo cultural del hombre y su
conocimiento de la naturaleza. Las civilizaciones antiguas ya usaban
tecnologías que demostraban su conocimiento de las transformaciones de
la materia, y algunas servirían de base a los primeros estudios de la química. Entre ellas se cuentan la extracción de los metales de sus menas, la elaboración de aleaciones como el bronce, la fabricación de cerámica, esmaltes y vidrio, las fermentaciones de la cerveza y del vino, la extracción de sustancias de las plantas para usarlas como medicinas o perfumes y la transformación de las grasas en jabón.

- ¿QUE ES LA MATERIA ?
En química, la materia se define como cualquier cosa que tenga masa en
reposo, volumen y se componga de partículas. Las partículas que componen
la materia también poseen masa en reposo, sin embargo, no todas las
partículas tienen masa en reposo, un ejemplo es el fotón. La materia
puede ser una sustancia química pura o una mezcla de sustancias.
- LAS PARTICULAS DE LA QUIMICA
Los átomos son las partes más pequeñas de un elemento (como el carbono, el hierro o el oxígeno).
Todos los átomos de un mismo elemento tienen la misma estructura
electrónica (responsable ésta de la mayor parte de las características
químicas), y pueden diferir en la cantidad de neutrones (isótopos). Las moléculas son las partes más pequeñas de una sustancia (como el azúcar), y se componen de átomos enlazados entre sí. Si tienen carga eléctrica, tanto átomos como moléculas se llaman iones: cationes si son positivos, aniones si son negativos.
El mol se usa como contador de unidades, como la docena (12) o el millar (1000), y equivale a 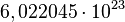 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
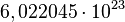 . Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
. Se dice que 12 gramos de carbono o un gramo de hidrógeno o 56 gramos de hierro contienen aproximadamente un mol de átomos (la masa molar
de un elemento está basada en la masa de un mol de dicho elemento). Se
dice entonces que el mol es una unidad de cambio. El mol tiene relación
directa con el número de Avogadro. El número de Avogadro fue estimado para el átomo de carbono por el químico y físico italiano Carlo Amedeo Avogadro,
Conde de Quarequa e di Cerreto. Este valor, expuesto anteriormente,
equivale al número de partículas presentes en 1 mol de dicha sustancia:
Dentro de los átomos pueden existir un núcleo atómico y uno o más electrones.
Los electrones son muy importantes para las propiedades y las
reacciones químicas. Dentro del núcleo se encuentran los neutrones y los
protones. Los electrones se encuentran alrededor del núcleo. También se
dice que el átomo es la unidad básica de la materia con características
propias. Está formado por un núcleo, donde se encuentran protones.
- LA MASA ATOMICA
La masa atómica es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.1 La masa atómica puede ser considerada como la masa total de protones y neutrones (pues la masa de los electrones en el átomo es prácticamente despreciable) en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico;
estos últimos difieren sutilmente de la masa atómica. La masa atómica
está definida como la masa de un átomo, que sólo puede ser de un isótopo
a la vez, y no es un promedio ponderado en las abundancias de los
isótopos. En el caso de muchos elementos que tienen un isótopo
dominante, la similitud/diferencia numérica real entre la masa atómica
del isótopo más común y la masa atómica relativa o peso atómico estándar
puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero
tal error puede ser crítico cuando se consideran átomos individuales.
Para elementos con más de un isótopo común, la diferencia puede llegar a
ser de media unidad o más (por ejemplo, cloro).
La masa atómica de un isótopo raro puede diferir de la masa atómica
relativa o peso atómico estándar en varias unidades de masa.

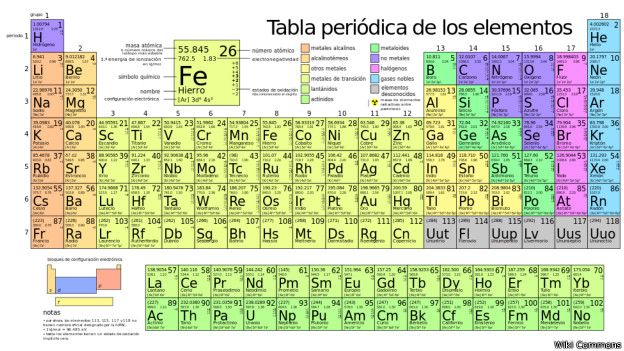
- LA TABLA PERIODICA
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas
similares. Debido a que las posiciones están ordenadas, se puede
utilizar la tabla para obtener relaciones entre las propiedades de los
elementos, o pronosticar propiedades de elementos nuevos todavía no
descubiertos o sintetizados. La tabla periódica proporciona un marco
útil para analizar el comportamiento químico y es ampliamente utilizada
en química y otras ciencias.
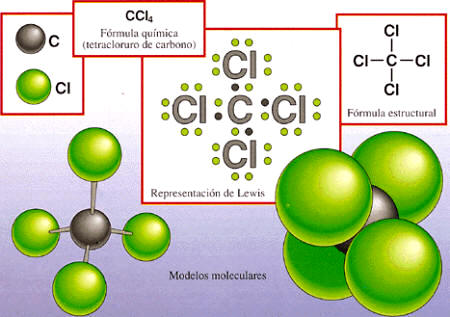
- FORMULA QUIMICA
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura química. Ejemplo: La fórmula general de los silanos1 es SinHm
A veces, los miembros de una familia química se diferencian entre sí por una unidad constante, generalmente un átomo de carbono adicional en una cadena carbonada.
Existen varios tipos de fórmulas químicas
- LA NOMENCLATURA
La nomenclatura química (del latín nomenclatūra) es un
conjunto de reglas o fórmulas que se utilizan para nombrar todos los
elementos y los compuestos químicos. Actualmente la IUPAC (Unión Internacional de Química Pura y Aplicada, en inglés International Union of Pure and Applied Chemistry) es la máxima autoridad en materia de nomenclatura química, la cual se encarga de establecer las reglas correspondientes.

Una corta explicacion
- LA FUNCION QUIMICA
Se llama Función química al conjunto de propiedades comunes que caracterizan a una serie de sustancias,
permitiendo así diferenciarlas de las demás. Este tipo de sustancias
tienen un comportamiento propio y específico en los procesos químicos.
Por ejemplo:
- la formacion quimica inorganica
La química inorgánica estudia la composición, formación, estructura y
las reacciones químicas de los elementos y los compuestos inorgánicos,
es decir, realiza los estudios de todos aquellos compuestos en los que
no participan los enlaces carbono-hidrógeno. Los compuestos inorgánicos
existen en menor proporción en cantidad y variedad que los compuestos
orgánicos.
Clasificación de los compuestos inorgánicos
Los compuestos inorgánicos se dividen según su estructura en:
- Compuestos binarios:
- Compuestos ternarios:
Nomenclatura de los compuestos inorgánicos
La
forma de nombrar a cada uno de los compuestos es diferente por cada uno
de los grupos que existen. Las reglas que se deben de seguir para
nombrarlos de forma correcta se encuentran en cada uno de los tipos de
compuestos. En cada sección podrás aprender las normas correctas para
saber nombrar a cada tipo de compuesto inorgánico ya sea óxido, hidruro,
sal binaria, etc.

- formacion quimica organica
La química orgánica es una rama de la química que estudia los
compuestos del carbono y sus reacciones. El carbono es el único elemento
capaz de formar más compuestos que ningún otro elemento ya que tiene la
capacidad de unirse entre sí formando cadenas lineales o ramificadas.
Un
átomo de carbono puede formar hasta cuatro enlaces covalente con cuatro
átomos diferentes. Las moléculas orgánicas son aquellas formadas por
enlaces covalentes como carbono-carbono, carbono-hidrógeno, etc.
Clasificación de los compuestos orgánicos
Los compuestos orgánicos atendiendo a su estructura se dividen en las siguientes funciones:
- Funciones hidrogenadas: formadas sólo por moléculas de carbono e hidrógeno.
- Halogenuros: sustitución de uno o más hidrógenos por (F, Cl, B, I)
- Funciones oxigenadas: formadas por átomos de carbono, hidrógeno y oxígeno.
- Funciones nitrogenadas: formadas átomos de carbono, hidrógeno, nitrógeno y pueden contener además átomos de oxígeno.
- Amidas
- Aminas
- Nitrilos
Nomenclatura de los compuestos orgánicos
Los
compuestos orgánicos se nombran de diferente manera dependiendo de la
función en la que se encuentre. Existen unas reglas específicas para
nombrar a estos compuestos de manera correcta. En cada uno de las
secciones de los compuestos orgánicos podrás aprender la nomenclatura
correcta para nombrar alcanos, alcoholes, aminas, anhídridos, etc.

- DOS VIDEOS REFERIDOS A LA HISTORIA DE LA QUIMICA
gracias por su atencion


No hay comentarios:
Publicar un comentario